Что такое карбид и как его производят, свойства и состав карбида и его получение, сколько стоит карбид
Состав и виды карбидов
Карбиды не являются отдельным веществом. Это соединение углерода с металлами и неметаллами. Причем, следует учитывать, что углерод должен обладать большей электроотрицательностью в получаемом веществе по сравнению с другими используемыми элементами. Это дает возможность избежать производства галогенов, оксидов и других углеродных соединений.

На сегодняшний день различают три вида карбида, состав которых отличен друг от друга:
- Ковалентные соединения. К данному виду относят два элемента — кремний и бром. Это соединения с прочной межатомной связью, что обеспечивает высокую температуру плавления и химическую инертность. Окисление веществ данной группы возможно только при их нагреве свыше 1000 градусов Цельсия. Твердость вещества с бромом настолько высока, что способна конкурировать даже с алмазами. Вещество с кремнием менее прочное, но 8 баллов по шкале Мооса имеет. При этом растворить данное вещество возможно только в царской водке или с помощью концентрированной азотной или плавиковой кислоты.
- Ионные соединения или солеобразные. Вещества данной группы образуются с помощью металлов 1 и 2 группы таблицы Менделеева, а также алюминием. Данные соединения характеризуются высокой температурой плавления. Карбиды ионного вида распадаются под воздействием воды и кислот. При протекании реакции выделяется углеводород и остается гидроксид металла.
- Ионно-ковалентно-металлические или металлоподобные соединения. Образуются с помощью металлов с 4 по 8 группу, а также кобальтом, никелем и железом. Отличительная особенность металлоподобных веществ — это высокая прочность и температура плавления. Данный вид соединений делится на два типа:
- Ацетилениды — при гидролизе образуют этин или ацетилен. Карбид кальция относится к данному типу соединений.
- Метаниды — при вступлении в реакцию с водой или разбавленными кислотами образуют метан. Чаще бесцветны. Сюда относят карбид алюминия, магния, бериллия.
References
- Brown Jr., Theodore L., H. Eugene LeMay, Bruce Edward Bursten, and Julia R. Burdge. 2002. Chemistry: The Central Science
. 9th ed. Upper Saddle River, NJ: Prentice Hall. - Chang, Raymond. 2006. Chemistry
. 9th ed. New York, NY: McGraw-Hill Science/Engineering/Math. - Cotton, F. Albert, and Geoffrey Wilkinson. 1980. Advanced Inorganic Chemistry
. 4th ed. New York, NY: Wiley. ISBN 0-471-02775-8. - Ettmayer, Peter, and Walter Lengauer. 1994. Carbides: transition metal solid state chemistry. In Encyclopedia of Inorganic Chemistry
. Editor in chief R. Bruce King. Chichester, UK: Wiley. ISBN 0-471-93620-0. - Greenwood, N.N., and A. Earnshaw. 1998. Chemistry of the Elements
. 2nd ed. Oxford, U.K.; Burlington, MA: Butterworth-Heinemann, Elsevier Science. ISBN 0750633654. Online version available here Retrieved January 4, 2008.
Константан сплав — свойства и применение
Физические свойства, особенности
Карбидные материалы обладают рядом характерных свойств, особенностей. Перечислим их:
- Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. Поэтому с помощью ударов разрушить карбидные вещества будет крайне сложно. Благодаря высокой твердости материалы нашли широкое распространение в различных технических сферах (от военного машиностроения до строительства).
- Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. Поэтому такой материал без проблем выдержит длительное воздействие экстремальных температур (скажем, его можно использовать в печах, металлургических ковшах для расплавления других материалов).
- Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). Вещества не вступают в реакцию с водой и атмосферным кислородом, поэтому они не покрываются ржавчиной, что обеспечивает их высокий срок годности.
- Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Поэтому они обладают повышенной износоустойчивостью, что делает их срок годности большим. Благодаря повышенной устойчивости материал часто применяют для изготовления абразивных и шлифовальных изделий, которыми можно пользоваться в течение большого срока.
Стоит обратить внимание, что далеко не все карбидные соединения обладают перечисленными свойствами. Скажем, карбид золота (I) чрезвычайно взрывоопасен (тогда как большинство других карбидов металлов — нет). Он может взорваться даже в случае неаккуратного пересыпания вещества на бумажную поверхность. Поэтому при рассмотрении физических и химических свойства карбидов нужно по отдельности рассматривать каждое соединение, поскольку карбидные материалы могут обладать уникальными необычными свойствами.


История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich Wöhler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Читайте также: Стеклопластиковая арматура: отзывы специалистов, опыт применения
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Свойства
Благодаря своим свойствам, эти соединения нашли широкое применение в машиностроении, а также в строительстве.
- Высокая твердость материала. У различных соединений она варьируется, но всегда остается выше средней. Они являются самыми твердыми минералами.
- Температура плавления. Практически всегда она выше температуры плавления металла входящего в соединение и может превышать 2000 градусов.
- Устойчивость к коррозии. Многие соединения не вступают в реакцию с различными кислотами и довольно устойчивы к внешним агрессивным факторам.
- Взаимодействие с водой. Практически все карбидные соединения вступают в реакцию с водой, например, при взаимодействии с карбидом кальция можно его взрывать. Условия взаимодействия могут отличаться и зависят от характера связи в соединении.
Примечания
- ↑ Косолапова Т. Я.
Карбиды. — Металлургия, 1968. — С. 300. - ↑ Третьяков В. И.
Основы металловедения и технологии производства спечённых твёрдых сплавов. — Металлургия, 1976. — С. 24—268. — 528 с. - Тот Л.
Карбиды и нитриды переходных металлов. — Мир, 1974. — С. 21—23. — 296 с. - Редкол.: Кнунянц И. Л. (гл. ред.).
Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 420—421. — 623 с. — 100 000 экз. - ↑ Самсонов Г. В.
Физическое материаловедение карбидов. — Наукова думка, 1974. — С. 79—397. — 454 с. - Киффер Р., Бенезовский Ф.
Твердые сплавы. — Металлургия, 1971. — С. 47. — 392 с. - ↑ Самсонов Г. В., Виницкий И. М.
Тугоплавкие соединения (справочник). — Металлургия, 1976. — С. 560. - Лидин Р. А., Молочко В. А., Андреева Л. Л.
Химические свойства неорганических веществ. — Химия, 2000. — С. 330. — 480 с. - Литера H (нем. Hartkern) в обозначении германских боеприпасов ВМВ означает «с твёрдым металлокерамическим сердечником».
- Так 20-мм БПС марки DM43 при стрельбе из пушки MK 20 RH 202 (начальная скорость 1100 м/с) на дальности 1000 м способен пробить 35 мм стальной брони при угле соударения 0°, но лишь 8 мм брони при угле 60°. Jane’s Infantry Weapons 1996—97, 456.
- Дмитрий Сафин.
(недоступная ссылка). Компьюлента (15 октября 2010). — Подготовлено по материалам Wiley. Дата обращения 16 октября 2010.
(3) КАРБИДНЫЙ СПЛАВ ТИПА
Эти марки в основном используются для резки стальных деталей, которые обычно имеют содержание кобальта в 5-10% и диапазон размеров зерен 0,8-2 мкм. Добавляя от 4% до 25% карбида титана (TiC), склонность карбида вольфрама (WC) диффундировать к поверхности стального лома может быть уменьшена. Прочность инструмента, износостойкость кратера и сопротивление термическому удару можно улучшить, добавив не более 25% карбида тантала (TaC) и карбида ниобия (NbC). Добавление таких кубических карбидов также увеличивает покраснение инструмента, что помогает избежать термической деформации инструмента во время сверхпрочной резки или другой обработки, когда режущая кромка может создавать высокие температуры. Кроме того, карбид титана может обеспечить места зародышеобразования во время спекания, улучшая однородность распределения кубического карбида в заготовке.
В целом, сплавы типа карбида имеют диапазон твердости HRA91-94 и прочность на разрыв в поперечном направлении 150-300 тыс.фунтов / кв.дюйм. По сравнению с простым типом износостойкость сплава имеет низкую износостойкость и низкую прочность, но его износостойкость лучше. Сплавы сплавов могут быть разделены на C5-C8 в системе класса С и могут классифицироваться в соответствии со стандартами класса P и M в системе качества ISO. Сплавы сплавов с промежуточными свойствами можно классифицировать как общие классы (например, C6 или P30) для токарной обработки, нарезания резьбы, строгания и фрезерования. Самые твердые сорта могут быть классифицированы как мелкие сорта (например, C8 и P01) для отделки и расточки. Эти сорта обычно имеют меньший размер зерна и более низкое содержание кобальта для достижения желаемой твердости и износостойкости. Однако аналогичные свойства материала могут быть получены путем добавления большего количества кубических карбидов. Наиболее устойчивые марки могут быть классифицированы как грубые (например, C5 или P50). Эти сорта обычно имеют средний размер частиц и высокое содержание кобальта, а количество добавленного кубического карбида также мало для достижения желаемой вязкости за счет ингибирования распространения трещины. В прерванном процессе поворота эффективность резания может быть дополнительно улучшена за счет использования богатого кобальтом сорта, имеющего более высокое содержание кобальта на поверхности резака.
Сплавы сплавов с низким содержанием карбида титана используются для обработки нержавеющей стали и ковкого чугуна, но могут также использоваться для обработки цветных металлов (таких как суперсплавы на основе никеля). Эти сорта обычно имеют размер зерна менее 1 мкм и содержание кобальта от 8% до 12%. Сорта с более высокой твердостью (например, M10) могут использоваться для обработки ковкого чугуна; марки с лучшей ударной вязкостью (например, M40) могут использоваться для фрезерования и строгания стали или для обработки нержавеющей стали или суперсплавов.
Сплавы карбида сплава также могут использоваться для неметаллической резки, прежде всего для изготовления износостойких деталей. Эти сорта обычно имеют размер частиц 1,2-2 мкм и содержание кобальта 7% -10%. При производстве этих сортов обычно добавляется большая доля переработанных материалов, что приводит к повышению экономической эффективности при применении изношенных деталей. Изношенные детали требуют хорошей коррозионной стойкости и высокой твердости. Эти марки могут быть получены путем добавления никеля и карбида хрома при производстве таких сортов.






















Intermediate transition metal carbides
In these carbides, the transition metal ion is smaller than the critical 135 pm, and the structures are not interstitial but are more complex. Multiple stoichiometries are common. For example, iron forms a number of carbides: Fe3C, Fe7C3, and Fe2C. The best-known of these is cementite (Fe3C), which is present in steels.
These carbides are more reactive than the interstitial carbides. For example, the carbides of Cr, Mn, Fe, Co, and Ni are all hydrolyzed by dilute acids and sometimes by water, to give a mixture of hydrogen and hydrocarbons. These compounds share features with both the inert interstitials and the more reactive, salt-like carbides.
Техника безопасности при работе с карбидом кальция.
Как уже Вам известно, карбид кальций – это взрывоопасное вещество и для обеспечения безопасной работы с ним необходимо выполнять несколько обязательных правил при использовании карбида для сварки. Главные положения, которые необходимо выполнять при сварочных работах на основе карбида кальция:
- Учитывайте, что карбид кальция активно взаимодействует с воздухом и водой, выделяя легковоспламеняющийся ацетиленовый газ
- Место хранения карбида для сварки должно быть сухим и герметичным.
- Карбид кальция также взрывоопасен, поэтому искры и открытый огонь рядом с веществом строго воспрещены.
- Пыль карбида (куски менее 2 мм) вызывают раздражения, попадая на кожу, глаза и слизистую оболочку рта, и носа.
- Регулярные сварочные работы с применением карбида кальция должны проводиться в специально оборудованном для сварки помещении, в котором нет горючих веществ, и присутствуют только несгораемые материалы. Жизненно важно, чтобы все оборудование, связанное с хранением и производством ацетилена было изолировано в отдельных отсеках сварочной мастерской, а само помещение для генераторов должно легко проветриваться и в случае чего деактивироваться.
- Установка генераторов ацетилена строго запрещена в подвальных комнатах.
- После завершения сварочных работ с применением карбида кальция как «топлива», в генераторах все оставшееся вещество дорабатывается, и полученные шлаки в виде известкового ила удаляем из генератора в специальную яму или бункер.
- Напомним, что карбид и ацетилен – взрывоопасные вещества. Поэтому курение, открытый огонь на расстоянии до 10 метров от места хранения отработанного карбида строго воспрещено.
- При перевозке и хранении ацетиленовых баллонов, на конструкцию клапанов должны быть навинчены предохранительные колпаки. Толчки и удары при транспортировке нескольких баллонов смертельно опасны. Хранение и перевозка ацетиленовых баллонов с другими веществами не допустима.
И напоследок отметим, что карбид кальция является высокоинтенсивным веществом для получения ацетиленового газа, что сводит к минимуму его расход. Кроме того, один килограмм ацетилена, полученного из карбида кальция, выделяет тепла около 8 тысяч кДж.
Кремнезем.
Диоксид кремния SiO2 используется в различных видах (кристаллический, стеклообразный) для придания изделиям формы и шлифования. Хотя разные виды кремнезема химически идентичны, они широко различаются по физическому состоянию, и поэтому каждый из них находит свое специфическое применение.
Диатомит, инфузорная земля, кизельгур и триполит состоят из кремнистых остатков окаменевших диатомовых водорослей. Они используются как мягкие абразивы в качестве компонентов полировальных порошков и паст, например пасты для чистки серебра.
Рухляк и трепел являются продуктами распада кремнистых известняков. Они также используются как компоненты чистящих и полировальных порошков и паст.
Дробленый кварц, кварцит, кремень, кремнистый сланец, песок и песчаник применяются в виде зерен как абразивы в обычной наждачной бумаге, а также для пескоструйной обработки и в чистящих пастах.
Недробленый песок с высоким содержанием кварца используется для пескоструйной обработки, а также для пилки и шлифовки мягкого камня, например мрамора.
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).


Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.


Твердость.
Процесс абразивной обработки можно сравнить с процессом обтесывания (зубилом, долотом, стамеской), поскольку материал удаляется с обрабатываемого изделия силовым воздействием острых выступов абразива. Поэтому твердость абразива – очень важный параметр. Германский минералог Ф.Моос установил первую шкалу относительной твердости различных минералов в 1820. По шкале Мооса твердость минералов оценивается значениями от 1 до 10 относительно 10 эталонов, в том числе талька (1), кварца (7) и алмаза (10). Шкала Мооса неравномерна, так что, например, изменение твердости при переходе от эталона 9 к эталону 10 больше, чем при переходе от эталона 1 к эталону 9.
При оценке искусственных абразивов возникла необходимость расширить шкалу Мооса. Р.Риджуэй добавил несколько чисел к верхнему краю шкалы и изменил положение некоторых верхних чисел Мооса. К.Вудделл измерил степень, с какой различные минералы сопротивляются царапанью алмазом в контролируемых условиях и ввел соразмерные числа выше числа Мооса 9 (корунд). Числа твердости по Кнупу определяются по размеру отпечатка, создаваемому при вдавливании в материал алмазной пирамиды под воздействием определенной нагрузки (см. табл.).
Таблица — Различные шкалы твердости
| РАЗЛИЧНЫЕ ШКАЛЫ ТВЕРДОСТИ | ||||
| Шкала твердости | ||||
| Материал | Мооса | Риджуэя | Вудделла | Кнупа |
| Песок | — | 7 | — | 475 |
| Ортоклаз | 6 | 6 | — | 560 |
| Кварц | 7 | 8 | 7 | 820 |
| Плавленый оксид циркония | 7,5 | 11 | — | 1160 |
| Топаз | 8 | 9 | — | 1250 |
| Гранат | 7–7,5 | 10 | — | 1360 |
| Корунд | 9 | — | 9 | 1635 |
| Плавленый глинозем | 9+ | 12 | 10–11 | 2000 |
| Карбид титана | — | — | — | 2300 |
| Карбид кремния | 9+ | 13 | 13,4–14 | 2450 |
| Карбид бора | 9+ | 14 | 19,7 | 2750 |
| Нитрид кремния | — | — | — | 3000 |
| Кубический нитрид бора | 9+ | — | — | 4700 |
| Алмаз | 10 | 15 | 40–42 | 8000–9000 |
Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
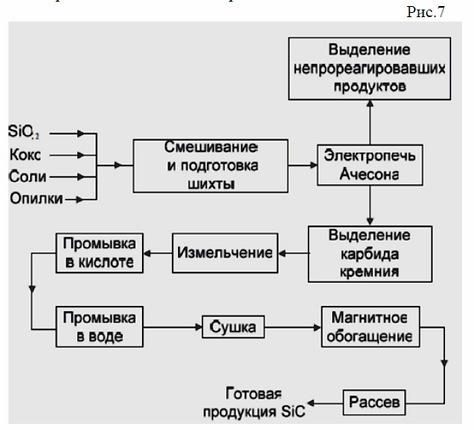
Производство карбида
Ковалентные и солеобразные соединения получают простым методом. В электрическую печь помещают смесь из дробленого кокса и оксида металла и нагревают. При высоких температурах оксид элемента вступает в реакцию с коксом. При таком способе часть кокса, которая состоит из углерода, соединяется с атомами элемента, входящими в оксид. В результате образуется требуемый карбид и угарный газ. Готовую расплавленную смесь разливают по специальным формам, а после застывания дробят и сортируют по размеру гранул. Несмотря на простоту данного способа, получение карбида с его помощью является довольно энергозатратным, поскольку требует поддержания высоких температур (1600-2500 градусов) на всем протяжении реакции.
Существуют и альтернативные способы получения некоторых видов веществ. Как правило, это разложение соединения в результате которого и получается требуемый элемент. Формула распада будет отличаться в зависимости от конкретного соединения.






Интересные соединения
Карбид натрия. Формула этого соединения C2Na2. Это можно представить скорее как ацетиленид (то есть продукт замещения атомов водорода в ацетилене на атомы натрия), а не карбид. Химическая формула полностью не отражает этих тонкостей, поэтому их надо искать в строении. Это очень активное вещество и при любом контакте с водой очень активно взаимодействует с ней с образованием ацетилена и щёлочи.
Карбид магния. Формула: MgC2. Интересны способы получения этого достаточно активного соединения. Один из них предполагает спекание фторида магния с карбидом кальция при высокой температуре. В результате этого получаются два продукта: фторид кальция и нужный нам карбид. Формула этой реакции достаточно проста, и вы можете при желании ознакомиться с ней в специализированной литературе.
Если вы не уверены в полезности изложенного в статье материала, тогда следующий раздел для вас.


Качественная реакция
Мало знаний о том, где найти карбид, необходимо удостовериться в подлинности вещества. Для качественной реакции понадобится всего лишь немного воды (на улице можно воспользоваться даже собственной слюной). При взаимодействии CaC 2 происходит выделение метана и гидроксида кальция. Можно наблюдать характерное шипение, а если поднести в этот момент спичку — воспламенение.
Во время Первой мировой войны в Канаде были установлены коммерческие процессы производства ацетальдегида, уксусной кислоты и ацетона; ацетон, в частности, необходим для изготовления взрывчатых веществ. В Германии после Первой мировой войны бутадиен, полученный из ацетилена, стал основой заменителя каучука, который сделал страну самодостаточной в каучуке. Уолтер Реппе впервые провел исследование химии ацетилена при давлениях до 200 атмосфер.
С помощью синильной кислоты ацетилен образует акрилонитрил, который затем можно полимеризовать и формовать в акриловые волокна. За последние 40 лет или около того ацетилен все чаще извлекается из нефти, но если запасы нефти уменьшатся достаточно, чтобы повысить цену выше добычи угля, промышленность может вернуться к углю, и карбид кальция снова станет основным путем к органическим химикатам.
Из-за бурной реакции с водой карбид разлагается от атмосферной влаги. Поэтому вопрос о том, где найти карбид кальция на улице, весьма спорный. Известно, что в чистом виде его не существует, данное соединение является в большей части искусственным, нежели природным.
Применение в промышленности
Карбид кальция является важным соединением для получения ацетилена, газа, который используется при кислородной сварке и обработке металлов. При горении с кислородом ацетилен способен достигать 3150 градусов Цельсия. Это позволяет работать с тугоплавкими металлами, требующими температуру вдвое большую,чем температура плавления самого металла.
Карбид бора используется как огнеупорный материал, поскольку температура плавления такого соединения выше 2400 градусов. При этом он же встречается в бронежилетах,так как способен защитить не только от пуль и осколков, но и от радиации. Для покрытия промышленного и строительного инструмента используют карбид титана. Его прочность позволяет повысить износостойкость деталей и обрабатывать даже самые прочные материалы.
Читайте также: Устройство монолитного перекрытия по металлическим балкам
Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.


Практическое применение карбидов
Как мы уже обсудили, ковалентные карбиды имеют самый большой диапазон практических применений. Это и абразивные и режущие материалы, и композиционные материалы, используемые в разных областях (например, в качестве одного из материалов, входящих в состав бронежилета), и автодетали, и электронные приборы, и нагревательные элементы, и ядерная энергетика. И это далеко не полный список применений этих сверхтвёрдых карбидов.
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Ionic carbides
Карбид кальция: свойства и применение. получение ацетилена
Salt-like, ionic carbides are formed by the following metals:
- group one metals (the alkali metals);
- group two metals (the alkaline earths);
- group three metals (scandium, yttrium, and lanthanum);
- group 11 metals (copper, silver, and gold);
- group 12 metals (zinc, cadmium, and mercury);
- only aluminum from group 13, (gallium, indium and thallium do not appear to form carbides);
- lanthanides, when forming MC2 and M2C3 carbides (where M is the metal);
- actinides, when forming MC2 and M2C3 carbides.
Most commonly, they are salts of C22− and are called acetylides, ethynides, acetylenediides, or (rarely) percarbides. Some ionic carbides contain other anionic species, such as:
- C4−, sometimes called methanides (or methides) because they hydrolyze to give methane gas;
- C34− ion, sometimes called sesquicarbides, which hydrolyze to give methylacetylene.
The naming of ionic carbides is not consistent and can be quite confusing.
Читайте также: ГОСТ 5264-80. Ручная дуговая сварка. Соединения сварные. Основные типы, конструктивные элементы и размеры
Acetylides
Acetylides contain the polyatomic ion C22−, in which there is a triple bond between the two carbon atoms (similar to acetylene). Examples are carbides of the alkali metals (such as Na2C2), some alkaline earths (such as CaC2) and lanthanoids (such as LaC2).
The C-C bond distance ranges from 109.2 picometers (pm) in CaC2 (similar to acetylene), to 130.3 pm in LaC2 and 134pm in UC2.
Methanides
Methanides contain the monatomic ion C4−. Examples of methanides are Be2C and Al4C3.
The C4− ion is a very strong base and will combine with four protons to form methane. The reaction may be written as follows:
C4− + 4H+ → CH4
Methanides commonly react with water to form methane, but reactions with other substances are also common.
Sesquicarbides
The polyatomic ion C34− is found in, for instance, Li4C3 and Mg2C3. The ion is linear and isoelectronic with CO2. The C-C distance in Mg2C3 is 133.2 pm. Hydrolysis of Mg2C3 yields methylacetylene (CH3CCH), which was the first indication that it may contain C34−.
Техника безопасности
Карбид для сварки относится к классу взрывоопасных веществ. Безопасное применение карбида обеспечивается учетом ряда условий:
- Ацетилен является легковоспламеняющимся газом, а сам сухой карбид также взрывоопасен, поэтому возле места проведения работ не должно быть источников открытого огня, даже таких незначительных, как зажигалки и зажженные сигареты.
- Запрещено использование карбида в гранулах до 2 мм или карбидной пыли, так как она растворяется очень быстро, что приводит к выделению большого количества газа. Из-за этого в генераторе образуется сверхвысокое давление и может произойти взрыв.
- Запрещена работа болгаркой или электросварочным аппаратом вблизи газосварочных работ и мест установки карбидных барабанов.
- Вещество должно храниться в сухом и герметичном месте, в котором нет водопроводов, канализационных труб и, тем более, газового оборудования.
- Карбидная пыль при попадании вызывает раздражение кожи, глаз, слизистых оболочек. Работа с этим веществом должна проходить с применением средств индивидуальной защиты – очков, перчаток и респиратора.
- При попадании карбида на кожу или в глаза его необходимо промыть большим количеством теплой воды, а затем аккуратно удалить остатки карбида пинцетом или влажным тампоном.
- При работе с карбидом в мастерской все сварочное оборудование должно быть размещено в отдельных частях помещения, система вентиляции помещения должна обеспечивать отвод горючих газов, а помещение должно быть освобождено от горючих материалов.


- Ацетиленовые генераторы запрещено устанавливать в подвальных помещениях и жилых зданиях.
- Перед запуском генератор следует осмотреть на предмет отсутствия видимых трещин и вмятин корпуса.
- Во время проведения работ генератор должен оставаться в вертикальном положении, манометр должен быть исправен и хорошо виден сварщику или его помощнику.
- По окончании работы оставшийся в генераторе раствор карбида должен быть выработан целиком, а образовавшаяся известь утилизирована.
- Повторное использование мокрых кусков карбида не допускается;
- Запрещено вскрывать генератор под давлением (во время продолжающейся реакции).
- Баллоны для ацетилена хранятся и перевозятся со специальными предохранительными колпаками на клапанах.
Если имеется необходимость в регулярном использовании оборудования для газовой сварки и резки, лучше купить профессиональное оборудование, изготовленное на промышленном предприятии. Применение самодельных генераторов чревато получением тяжелых травм и угрозой для жизни.
Хранение и транспортировка
Поскольку карбид при вступлении в реакцию с влагой приводит к выделению большого количества тепла и взрывоопасного газа ацетилена, хранят данное вещество в герметичных баках или барабанах. Работа с такими баками требует особой осторожности. Газ ацетилен легче воздуха и способен самовоспламеняться, при этом обладает наркотическим действием. При вскрытии барабанов с карбидом используют специальный инструмент, исключающий возникновение искр, а при попадании вещества на кожу требуется немедленно промыть водой пораженный участок и смазать жирным кремом.
Помещения хранения должны хорошо проветриваться, а содержание других веществ по соседству — запрещено. Это может привести к опасным реакциям. Неправильное хранение может как взорвать карбид, так и привести его в негодное состояние.
Срок хранения доходит всего до полугода.
Перевозка осуществляется только крытым транспортом. Воздушная доставка запрещена.






Применение при сварочных работах
Хранение карбида осуществляется в специальных стальных баках объемом 100 или 130 литров. Открытие этих баков должно производиться только при отсутствии огня или искр в близости от них деревянным молотком и латунным зубилом. Неиспользованный карбид в банке закрывается водонепроницаемой крышкой.
Ацетилен для сварочных работ вырабатывается из карбида в генераторе стационарного или мобильного типа и разного объема. Средний объем ацетиленовых генераторов рассчитан на прием от 5 до 15 литров воды и, соответственно, 2-5 килограммов карбида. Выход ацетилена считается несколько ниже теоретического и принимается равным 260-280 литров с одного килограмма CaC2. Рекомендуется использовать карбид крупной фракции – 80 мм


Принцип использования ацетилена для сварочной работы таков:
- Из одного килограмма карбида выделяется около 250 литров ацетилена, а на разложение килограмма карбида уходит 3-4 литра воды. Зная эти пропорции, вычисляют необходимый объем воды и количество вещества.
- В промышленных генераторах, рассчитанных на долгий и равномерный процесс использования, карбид дозировано загружается в газообразующую камеру через специальный бункер в автоматическом режиме. В генераторах, которые используются для ненормированных объемов работ, карбид погружается в воду в специальной корзине. Объем вырабатываемого ацетилена регулируется погружением или подъемом корзины.
- При подаче очередной порции карбида и начале реакции в камере возрастает давление, снижение которого производится активным выпуском ацетилена в горелку.
- Ацетилен через отборник по шлангу подается в газовую горелку. Горелка должна находиться от генератора на расстоянии не менее 10 метров.
- Гашеная известь, образующаяся в процессе реакции (около 1,2 кг на каждый килограмм карбида), удаляется из генератора через отдельный бункер.


В газовой сварке главным плюсом применения карбида является его низкий вес и небольшой вес применяемого оборудования. Газовые баллоны для ацетилена очень тяжелые, их необходимо перемещать на специальной тележке или в 2-3 пары рук. Средний же генератор весит 15-20 кг, что позволяет без особых усилий перемещать его в одиночку или с одним помощников. При перемещении сухого карбида достаточно соблюдать элементарные правила хранения – избегать попадания влаги на вещество и попадание мелкой карбидной пыли на кожу и в глаза.

